Teoria Cinética de gases
Em 1738, o físico matemático Daniel Bernoulli, publicou Hidrodinâmica, a base para a teoria cinética dos gases. Nesse trabalho, Bernoulli posicionou seu argumento, ainda sólido até a atualidade, que os gases consistem em um grande número de moléculas se movendo em todas as direções, onde elas colidem entre si e esse impacto causa uma pressão na superfície de contato que podemos sentir.
A seguir as hipóteses da teoria cinética, a respeito dos gases perfeitos:
lei de Boyle
Em uma transformação isotérmica, envolvendo um gás perfeito, o produto entre pressão e volume é constante. É possível calcular a pressão e o volume desse gás através da fórmula:

Lei De Gay-Lussac
Dentro do âmbito da Química e da Física a Lei de Gay-Lussac é uma lei dos gases perfeitos que estabelece que sob um volume e quantidade de gás constantes, a pressão é diretamente proporcional à temperatura.
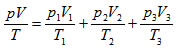
A seguir as hipóteses da teoria cinética, a respeito dos gases perfeitos:
- Uma porção de gás perfeito é constituída por um grande número de moléculas em movimento caótico.
- As moléculas são consideradas pontos materiais.
- As colisões entre duas moléculas ou entre uma molécula e uma parede do recipiente são supostas perfeitamente elásticas.
- Cada colisão tem duração desprezível.
- Entre colisões sucessivas, o movimento das moléculas é retilíneo.
- As forças intermoleculares só se manifestam durante as colisões.
- O estudo das colisões das moléculas pode ser feito com base na mecânica newtoniana
lei de Boyle
Em uma transformação isotérmica, envolvendo um gás perfeito, o produto entre pressão e volume é constante. É possível calcular a pressão e o volume desse gás através da fórmula:

Lei De Gay-Lussac
Dentro do âmbito da Química e da Física a Lei de Gay-Lussac é uma lei dos gases perfeitos que estabelece que sob um volume e quantidade de gás constantes, a pressão é diretamente proporcional à temperatura.
Lei De Dalton
A Lei de Dalton refere-se às pressões parciais dos vários gases componentes de uma mistura gasosa.
Consideremos uma mistura gasosa contida num recipiente rígido de volume V.
Seja p a pressão exercida pela mistura.
Se por um processo qualquer deixarmos no recipiente apenas as partículas de um dos gases componentes da mistura, retirando todas as outras, o gás que permaneceu ocupará sozinho todo o volume V do recipiente e exercerá uma pressão p1 < p.
Em outras palavras, a pressão parcial de um gás é a pressão que este exerceria se ocupasse sozinho, à mesma temperatura, todo o volume da mistura gasosa à qual pertence.
Dalton, após analisar este fenômeno, chegou à conclusão de que:
“A esta pressão denominaremos pressão parcial do gás 1 na mistura gasosa.
A soma das pressões parciais dos gases componentes de uma mistura gasosa é igual à pressão total exercida pela mistura, desde que os gases não reajam entre si.”
Ou seja:
Ptotal = P1 + P2 + P3 + ... + Pn
Assim, pela equação de Clapeyron chegamos à expressão:
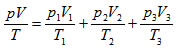
Lei de Avogadro
Volumes iguais de dois gases, nas mesmas condições de temperatura e pressão, possuem o mesmo número de moléculas. Essa lei que foi a origem do conceito de molécula está implícita no conceito de volume molar (a CNTP), pois 22,4 litros de qualquer gás possuem 6,02 x 1023 moléculas.
Volumes iguais de dois gases, nas mesmas condições de temperatura e pressão, possuem o mesmo número de moléculas. Essa lei que foi a origem do conceito de molécula está implícita no conceito de volume molar (a CNTP), pois 22,4 litros de qualquer gás possuem 6,02 x 1023 moléculas.
Do número de Avogadro, sabemos que há aproximadamente 6,02 x 1023 átomos/mol. Então, em 0,0142 mol temos :
(0,0142 mol) x (6,02 x 1023 átomos/mol) = 8,55 x 1021átomos


Nenhum comentário:
Postar um comentário